Comprometidos con la información que impulsa la innovación
ACTUALIDAD
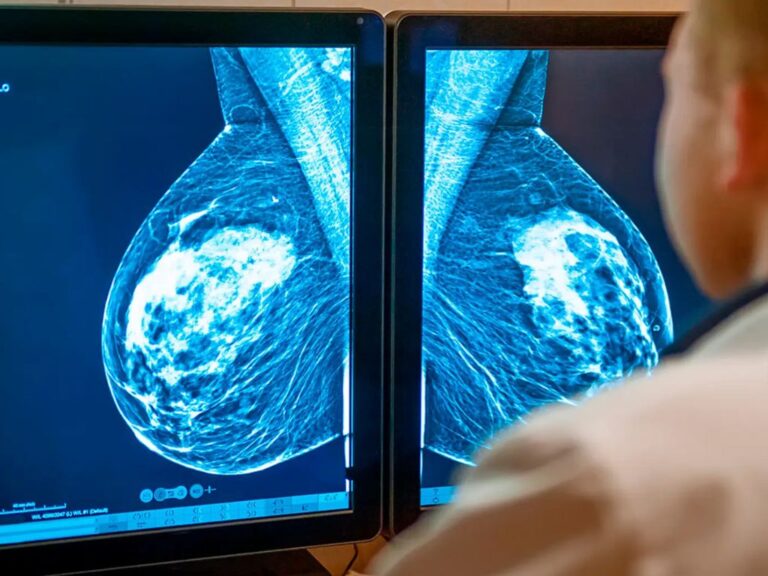
Cáncer de mama triple negativo: dianas terapéuticas y decisión clínica
Contenido informativo para profesionales de la salud; no sustituye la evaluación clínica.
Resumen
El cáncer de mama triple negativo (TNBC) representa ~10–15% de los tumores mamarios y se caracteriza por ausencia de RE/RP y de amplificación de HER2. Es biológicamente heterogéneo y con mayor agresividad clínica. El abordaje actual integra histopatología, inmunohistoquímica y un perfil molecular dirigido a biomarcadores con impacto pronóstico y/o terapéutico (p. ej., BRCA1/2 para inhibidores PARP, PD-L1 para inmunoterapia, NTRK para terapias agnósticas, MSI-H para indicación inmunoterapéutica, EGFR/VEGF por IHQ).
CIDEGEN ofrece un panel integral en FFPE que consolida estas determinaciones y estandariza el flujo diagnóstico para apoyar decisiones terapéuticas personalizadas en TNBC.
Contexto epidemiológico
El TNBC supone ~10–15% de los cánceres de mama y suele asociarse a mayor tasa de proliferación y a presentación en mujeres más jóvenes que otros subtipos. Su heterogeneidad biológica y la asociación frecuente con fenotipo basal-like, así como su pronóstico clínico adverso es mayor en comparación con otros subtipos.
Fisiopatología y clasificación
El TNBC carece de dianas endocrinas y HER2, por lo que el subtipo basal-like (citoqueratinas 5/6 por IHQ) y alteraciones en vías de reparación del ADN, EGFR/VEGF y PI3K/AKT/mTOR pueden condicionar sensibilidad a terapias dirigidas o inmunoterapia.
Fisiopatología y clasificación
El TNBC carece de dianas endocrinas y HER2, por lo que el subtipo basal-like (citoqueratinas 5/6 por IHQ) y alteraciones en vías de reparación del ADN, EGFR/VEGF y PI3K/AKT/mTOR pueden condicionar sensibilidad a terapias dirigidas o inmunoterapia.
Vía diagnóstica: algoritmo práctico
Confirmación IHQ/ISH de triple negatividad (RE–/RP–/HER2 no amplificado).
Caracterización histopatológica y evaluación clínica (estadio y sitios de enfermedad).
Solicitar el panel CIDEGEN TNBC (FFPE) cuando el resultado molecular pueda:
- Habilitar terapias dirigidas o inmunoterapia (p. ej., BRCA1/2 → PARPi; PD-L1/MSI-H → inmunoterapia; NTRK → inhibidores TRK).
- Apoyar la inclusión en ensayos clínicos.
4. Comité oncológico: integrar biomarcadores + factores clínico-patológicos para decisión de quimioterapia, inmunoterapia y/o terapias dirigidas.
Panel Cáncer de Mama Triple Negativo - Código 60-00060
Indicación clínica y momento asistencial
Tumores triple negativos (RE–/RP–/HER2–) en tejido FFPE, tanto en enfermedad primaria como en recurrencia/metástasis, cuando el resultado pueda modificar la estrategia terapéutica (terapias dirigidas, inmunoterapia) o elegibilidad a ensayos.
Útil en muestras postquirúrgicas o de biopsia con celularidad tumoral adecuada.
Tipo de muestra y requisitos pre-analíticos
- FFPE
Metodología/tecnología
- NGS para BRCA1/BRCA2 con confirmación de deleciones/duplicaciones por MLPA.
- qPCR para PIK3CA (cobertura de 17 mutaciones; plataforma Roche Cobas® IVD).
- IHQ para PD-L1, EGFR y VEGF (clones aprobados por guías clínicas).
- PCR para MSI (panel BAT-25, BAT-26, NR-21, NR-24, MONO-27; con Penta C/D como controles).
- FISH para reordenamientos NTRK1/2/3 (sondas CE-IVD).
Genes/biomarcadores clave
PIK3CA, BRCA1, BRCA2, VEGF, EGFR, PD-L1, MSI, NTRK1, NTRK2, NTRK3.
Cobertura analítica y limitaciones
Cubre SNV/indels en BRCA1/2 (± CNV por MLPA), mutaciones PIK3CA por panel validado, expresión por IHQ (PD-L1/EGFR/VEGF), MSI por PCR e inestabilidad definida por panel de 5 marcadores, y fusiones NTRK por FISH.
Limitaciones: VAF muy bajos, material escaso/dañado, heterogeneidad intratumoral y discordancia entre IHQ y biología funcional. En fusiones NTRK, FISH puede requerir correlación con NGS RNA según disponibilidad clínica.
TAT: 15 días hábiles.
Interpretación clínica y toma de decisiones
BRCA1/2 patogénicas (germinal/somático): abren la puerta a inhibidores PARP en escenarios definidos.
PD-L1 positivo (IHQ): puede fundamentar inmunoterapia combinada; el material menciona ejemplos de atezolizumab/pembrolizumab en combinación con quimioterapia en avanzado.
MSI-H: criterio para inmunoterapia en enfermedad metastásica/irresecable.
Reordenamientos NTRK: habilitan terapia agnóstica (p. ej., entrectinib); el dossier subraya su aplicabilidad transversal.
PIK3CA: el documento describe el papel de la vía PI3K/AKT/mTOR; la interpretación clínica en TNBC debe individualizarse por escenario y evidencia disponible.
EGFR/VEGF por IHQ: Por su posible uso con terapias dirigidas seleccionadas; considerar ensayos clínicos y guías vigentes.
Recomendación operativa: Discuta cada caso en comité integrando estadio, carga metastásica, comorbilidades, preferencias de la paciente y biomarcadores del panel. Priorice estrategias con beneficio clínico probado y considere inclusión en ensayos cuando corresponda.
Caso práctico (ilustrativo)
Paciente de 45 años, TNBC T2N1. Panel CIDEGEN: PD-L1 positivo por IHQ; MSI estable; BRCA1/2 sin variante patogénica; NTRK negativo. La decisión del comité considera quimioterapia con inmunoterapia basada en PD-L1, con reevaluación radiológica a intervalos definidos. (Caso docente; no corresponde a un paciente real de CIDEGEN.)
¿Desea coordinar una asesoría o solicitar el Panel Cáncer de Mama Triple Negativo (60-00060)?
Contacte a nuestro equipo para indicaciones clínicas, requisitos de envío y logística.
Referencias
- Loibl, S., Poortmans, P., et al. (2024). Early breast cancer: ESMO Clinical Practice Guideline. Annals of Oncology, 35(2), 159–182.
- Schmid, P., Cortes, J., et al. (2020). Pembrolizumab for early triple-negative breast cancer. New England Journal of Medicine, 382(9), 810–821. https://doi.org/10.1056/NEJMoa1910549
- Cortes, J., Cescon, D. W., et al. (2022). Pembrolizumab plus chemotherapy in advanced triple-negative breast cancer (KEYNOTE-355): Final overall survival analysis. New England Journal of Medicine, 387(3), 217–226. https://doi.org/10.1056/NEJMoa2202809
- Tutt, A. N. J., Garber, J. E., et al. (2021). Adjuvant olaparib for BRCA1- or BRCA2- mutated breast cancer (OlympiA). New England Journal of Medicine, 384(25), 2394–2405. https://doi.org/10.1056/NEJMoa2105215
- ESMO Open Expert Group. (2020). How to manage cancers with NTRK gene fusions. ESMO Open, 5(6), e000799. https://doi.org/10.1136/esmoopen-2020- 000799
Compartir
Cómo la amplificación de NECTIN4 se relaciona con la respuesta a enfortumab
vedotina
Cómo la amplificación de NECTIN4 se relaciona con la respuesta a enfortumab
vedotina

Cómo la amplificación de NECTIN4 se relaciona con la respuesta a enfortumab
vedotina
